氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,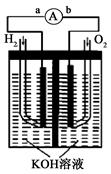 请回答:
请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为_______(用a、b表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因是________________________。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定, 请回答:
请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为_______(用a、b表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因是________________________。