硫代硫酸钠(Na2S2O3)可由下面一系列反应制得:
①Na2CO3+SO2 =Na2SO3+CO2 ②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O ④Na2SO3 + S Na2S2O3
Na2S2O3
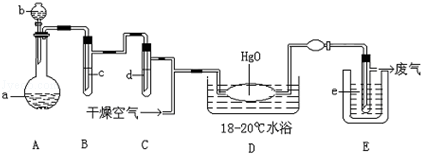
常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。
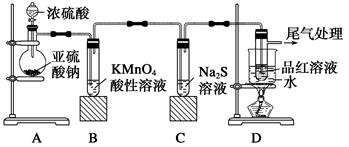
Ⅰ.现按如下方法制备Na2S2O3·5H2O:将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
请问:仪器2的名称为 ,装置6中可放入 。
| A.BaCl2溶液 | B.浓H2SO4 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:
(1)为减少产品的损失,操作①为 ,操作②是减压过滤、洗涤、 ,其中洗涤操作是用 (填试剂)作洗涤剂。
(2)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为 mol/L。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号