(本题共12分)某化学小组的同学模拟工业制硝酸设计了如下图所示的装置。已知:
CaCl2+ nH2O→CaCl2·nH2O;CaCl2+ 8NH3→[Ca(NH3)8]Cl2
根据题意完成下列填空: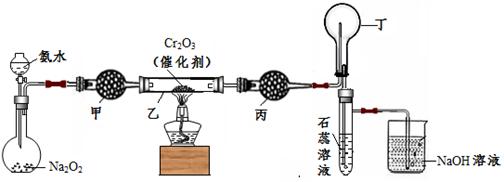
33.分液漏斗中氨水的浓度为9.0mol/L。现用质量分数为0.35、密度为0.88g/cm3的氨水配制9.0mol/L的氨水100mL,需要的定量仪器有 (选填编号)。
a.100mL容量瓶 b.10mL量筒 c.50mL量筒 d.电子天平
34.受热时,乙中反应的化学方程式为 。
35.实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有 。
36.干燥管甲的作用是 ;丙中盛放的药品为 (选填下列编号),其目的是 。
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
37.丁中除了NO之外,还可能存在的气体有 (填写化学式)。烧杯中发生反应的化学方程式 、 。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号