某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案一: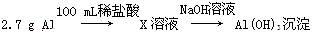
方案二: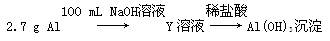
已知:NaOH溶液和稀盐酸的浓度均是3 mol·L-1,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
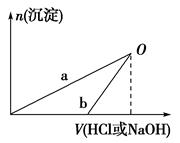
| A.在O点时两方案中所得溶液的溶质物质的量相等 |
| B.b曲线表示的是向X溶液中加入NaOH溶液 |
| C.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D.a、b曲线表示的反应都是氧化还原反应 |
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案一: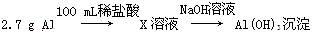
方案二: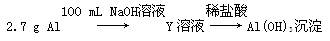
已知:NaOH溶液和稀盐酸的浓度均是3 mol·L-1,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )

| A.在O点时两方案中所得溶液的溶质物质的量相等 |
| B.b曲线表示的是向X溶液中加入NaOH溶液 |
| C.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D.a、b曲线表示的反应都是氧化还原反应 |