I.已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10-1 |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
(1)25℃时,将20 mL 0.1 mol/LCH3COOH溶液和20 mL0.1 mol/LHSCN溶液分别与20 mL 0.1 mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是: 。
(2)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是____(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
II.某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH = 11。在此温度下,将pH = 2的H2SO4溶液Va L与pH = 12的NaOH溶液Vb L混合,若所得混合液为中性,则Va︰Vb = 。
III.如图所示,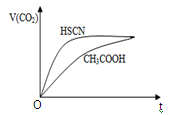
A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液见图。
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为 极,通电开始时,滤纸d端的电极反应式是: ;
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示。
则Cu2+、X3+、H+氧化能力由大到小的顺序是 ;D装置中溶液是H2SO4,则此装置电极C端的实验现象是:____________________。
 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
 N2O4(g)△H=-56.9 kJ/mol
N2O4(g)△H=-56.9 kJ/mol CH3OH(g)
CH3OH(g)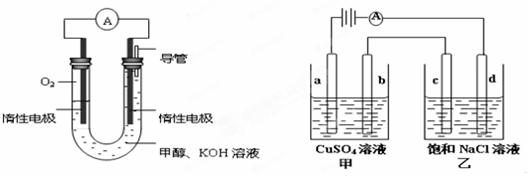
 粤公网安备 44130202000953号
粤公网安备 44130202000953号