向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
I.CH4(g)+2O2(g)  CO2(g)+2H2O(g) ΔH1=一802.6 kJ/mol
CO2(g)+2H2O(g) ΔH1=一802.6 kJ/mol
II. CH4(g)+O2(g)  CO2(g)+2H2 (g) ΔH2=一322.O kJ/mol
CO2(g)+2H2 (g) ΔH2=一322.O kJ/mol
III. CH4(g)+ H2O(g)  CO(g)+3H2 (g) ΔH3=+206.2 kJ/mol
CO(g)+3H2 (g) ΔH3=+206.2 kJ/mol
IV. CH4(g)+ 2H2O(g)  CO2 (g)+4H2 (g) ΔH4=+165.O kJ/mol
CO2 (g)+4H2 (g) ΔH4=+165.O kJ/mol
请回答下列问题:
(1)CH4的燃烧热ΔH ΔH1(填“>”“<”或“=”)。
(2)在反应初始阶段,反应Ⅱ的反应速率大于反应Ⅲ的反应速率。比较反应Ⅱ的活化能EⅡ和反应Ⅲ的活化能EⅢ的大小.EⅡ EⅢ(填“>”、“<”或“=”)。
(3)在1 L固定容积密闭容器中投入1.8 mol CH4和3.6 mol H2O(g),若只发生反应Ⅳ,测得CH4、H2O(g)及某一生成物的物质的量浓度(c)随反应时间(t)的变化如图所示[第9 min前H2O(g)的物质的量浓度及第4 min~9 min之间X所代表生成物的物质的量浓度变化曲线未标出,条件有变化时只考虑改变一个条件)。
①O~4 min内,H2的平均反应速率V(H2)= mol·(L·min)-1;
②反应在5 min时的平衡常数K= ;
③第6 min时改变的条件是 ;判断理由是 ;
④比较第5 min时的平衡常数K(5 min)与第10 min时平衡常数K(10 min)的大小:K(5 min) K(10 min) (填“>”、“=”或“<”),原因是 。
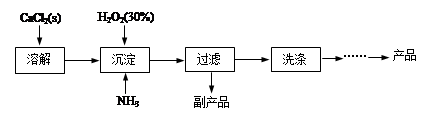

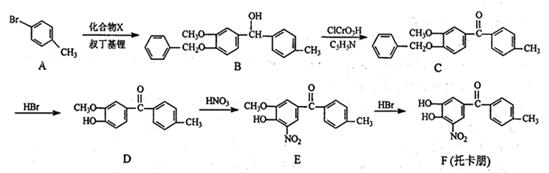
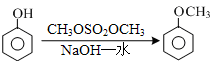 结合流程信息,写出以对甲基苯酚和硫酸二甲酯(
结合流程信息,写出以对甲基苯酚和硫酸二甲酯(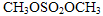 )为原料,制备
)为原料,制备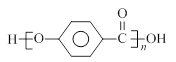 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
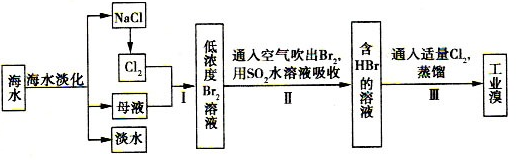

 RCH2OH
RCH2OH

 粤公网安备 44130202000953号
粤公网安备 44130202000953号