(14分)氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是 。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.已停止实验时,应先停止通入H2,后停止加热。
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化。该小组甲同学对反应后的固体产物成分提出如下假设。
假设l:含有Ca 和CaH2。
假设2:含有CaH2和CaO。
假设3:含有 。
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| 取少量固体样品,… |
|
(4)定量实验 测定Ca 和CaH2 混合物中CaH2的质量分数。
①取m1g样品与水完全反应,利用如图装置测定生成的气体体积时,在 时进行收集(填字母)
a.刚开始有气泡时 b.气泡连续均匀时 c.气体经过验纯后,再收集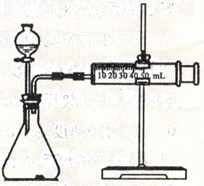
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数 (天“偏高”、“偏低”“无影响”)
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要讲金属钙制备成氢化钙呢?你的观点是 。

 gNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________________,现象是___________________________________________。
gNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________________,现象是___________________________________________。
 (填仪器名称)中;
(填仪器名称)中; 璃棒2—3次,每次洗涤的液体都要小心转入容量瓶,并轻轻摇匀;
璃棒2—3次,每次洗涤的液体都要小心转入容量瓶,并轻轻摇匀;

 粤公网安备 44130202000953号
粤公网安备 44130202000953号