一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,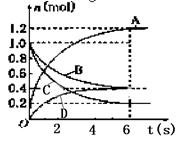
请回答下列问题:
(1)写出该反应的化学方程式: 。
(2)0-6 s内,B的平均反应速率为: 。
(3)下列说法正确的是( )
A.反应进行到1 s时,v(A)=v(D)
B.反应进行到6 s时,各物质的反应速率相等
C.反应进行到6 s时反应停止。
D.当反应达到平衡状态时4v(A)=5v(C)
相关知识点


 粤公网安备 44130202000953号
粤公网安备 44130202000953号