(选做题12分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是 。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用 。
(3)Ⅲ中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式 。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42的操作是 。
(5)已知煅烧FeC03的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是 Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是 Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)


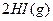 已达到平衡。将活塞外拉,则:
已达到平衡。将活塞外拉,则: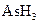 、
、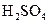 、
、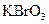 、
、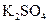 、
、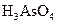 、
、 和一种未知物质X。(1)已知
和一种未知物质X。(1)已知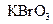 在反应中得到1mol电子生成X,则X的化学式为。(3)根据上述反应可推知。
在反应中得到1mol电子生成X,则X的化学式为。(3)根据上述反应可推知。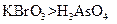 b.氧化性:
b.氧化性:
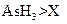 d.还原性:
d.还原性: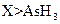
 粤公网安备 44130202000953号
粤公网安备 44130202000953号