常温下有0.1 mol·L-1四种溶液NaOH、NH3·H2O、HCl 、CH3COOH
(1)已知CH3COOH溶液的pH=3,其电离度为 ,由水电离的c(H+)= mol·L-1。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线 ,a、b两点中,导电能力更强的是 。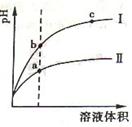
(3)NH3·H2O溶液和HCl溶液等体积混合后,溶液呈酸性的原因是(用离子方程式表示) 。此时,该混合溶液中的微粒浓度关系正确的是 。
| A.c(Cl-)>c(H+) >c(NH4+)>c(OH-) | B.c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| C.c(NH4+)+ c(NH3·H2O)= 0.1mol·L-1 | D.c(H+) = c(NH3·H2O)+c(OH-) |
(4)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)> V(HCl),当溶液中c(NH3·H2O)= c(NH4+)时,溶液的pH= ,该混合液中加入少量的酸或碱,结果发现溶液的pH变化不大,其原因是 。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
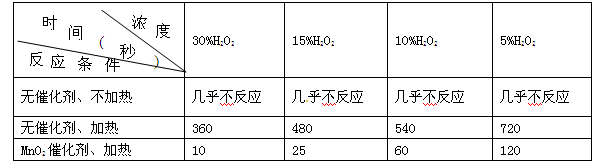
 4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________
4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________ ;
;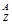 X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求: 粤公网安备 44130202000953号
粤公网安备 44130202000953号