写出下列化合物的名称或结构简式:
(1)结构简式为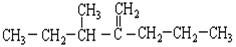 此烃名称为 。
此烃名称为 。
(2)结构简式为 的烃可命名为 。
的烃可命名为 。 (3)2,5-二甲基-2,4-己二烯 的结构简式: 。
(3)2,5-二甲基-2,4-己二烯 的结构简式: 。
(4)结构简式为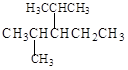 的烃可命名为: 。
的烃可命名为: 。
写出下列化合物的名称或结构简式:
(1)结构简式为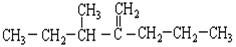 此烃名称为 。
此烃名称为 。
(2)结构简式为 的烃可命名为 。
的烃可命名为 。 (3)2,5-二甲基-2,4-己二烯 的结构简式: 。
(3)2,5-二甲基-2,4-己二烯 的结构简式: 。
(4)结构简式为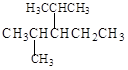 的烃可命名为: 。
的烃可命名为: 。