亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。
它在碱性环境中稳定存在。
(1)NaClO2中Na、Cl、O原子半径由大到小的顺序为________________________,Cl元素在周期表中的位置为_______________________。
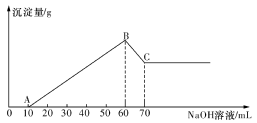
(2)NaClO2变质可分解为NaClO3和NaCl。分别取等质量未变质和部分变质的NaClO2试样配成溶液,与足量FeSO4溶液反应,消耗Fe2+的物质的量_____________(填相同、不相同)。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaC1O2+4HCI= 5NaCl+4C1O2↑+2H2O该反应中氧化剂和还原剂的物质的量之比是___________。
(4)常温时,HCIO2的电离平衡常数Ka=1.07×10-2 mol·L-1。
①NaClO2溶液中离子浓度大小顺序为__________________________________。
②常温时,l00mL 0.0lmol/L HClO2溶液与l0mL 0.1mol/L HClO2溶液相比,下列数值前者大于后者的有_ ________________,
| A.ClO2-的物质的量 | B.c(OH -) | C.电离平衡常数 | D.c(HClO2) |
③NaClO2溶液(含少量NaOH)的pH=13,则溶液中 =___________。
=___________。
 键和1个大
键和1个大 键,苯是非极性分子
键,苯是非极性分子
 7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。 2SO3(g) ΔH=-196.6 kJ·mol-1;
2SO3(g) ΔH=-196.6 kJ·mol-1; 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 molCO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 molCO,测得CO2的体积分数随时间t变化曲线如图。请回答:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号