根据热化学方程S ( s ) + O2 ( g ) = SO2 ( g ) △H = -297.23 kJ/mol (反应在298K,101kPa下发生)分析下列说法正确的是
| A.标况下,燃烧1mol S吸收的热量为297.23 kJ |
| B.S ( g ) + O2 ( g ) = SO2 ( g ) 放出的热量大于297.23 kJ |
| C.S ( g ) + O2 ( g ) = SO2 ( g )放出的热量小于297.23 kJ |
| D.形成1 mol SO2的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
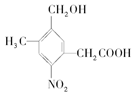 取Na、NaOH和Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需Na、NaOH和Cu(OH)2三种物质的物质的量之比为
取Na、NaOH和Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需Na、NaOH和Cu(OH)2三种物质的物质的量之比为 粤公网安备 44130202000953号
粤公网安备 44130202000953号