(共17分)浓硫酸具有强氧化性,能与金属铜反应,现用浓硫酸与铜反应制得SO2并进行相关实验探究。
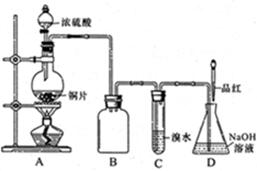
(1)装置A中发生反应的化学方程式是_______,盛放浓硫酸的仪器名称是 ,
装置B的作用是 ___ ____。
(2)设计装置C的目的是验证SO2的_______________性,D中NaOH全部转化为NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到目的是________(填序号);
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用PH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
| 实验序号 |
实验操作 |
现象 |
反应的可能情况 |
| ① |
滴加少量淀粉碘化钾溶液,振荡 |
|
III |
| ② |
滴加少量棕红色的KI3溶液,振荡 |
|
II |
| ③ |
滴入加少量酸性KMnO4溶液,振荡 |
溶液呈紫色 |
|
| ④ |
加入几小块CaCO3固体 |
有气泡产生 |
|

 粤公网安备 44130202000953号
粤公网安备 44130202000953号