(共18分)随着电子工业的发展,电子废料和电子废料逐步增多,这些电子废料和垃圾常常含有重要金属元素,具有回收价值,如一种含铝、锂、钴的新型电子材料,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:

(1)金属铝的化学性质活泼,但铝箔在空气中能稳定存在,原因是 ,则步骤I加碱后铝箔首先发生的反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) ,若消耗0.2molNa2S2O3,转移电子数目为 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
(5)工业制取的Na2CO3常常含有NaHCO3杂质,下列各说法正确的是______(填序号)。
| A.可采用加热的方法除去Na2CO3固体中的NaHCO3杂质 |
| B.向某无色溶液中滴加稀盐酸,生成无色无味的气体,通入澄清石灰水变浑浊,则溶液一定含有CO32‾ |
| C.实验室有两瓶失去标签的试剂,分别为Na2CO3溶液和稀盐酸,不用其它试剂即可鉴别 |
| D.可用Ca(OH)2鉴别Na2CO3与NaHCO3 |
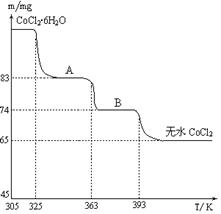
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。
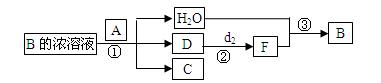
 是;在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 。
是;在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 。 a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。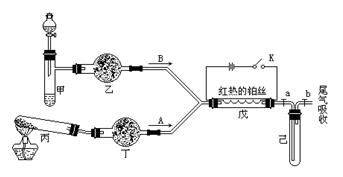
 。
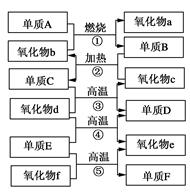
。
 硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是,反应中所消耗的硝酸的物质的量可能为。
硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是,反应中所消耗的硝酸的物质的量可能为。 击战取得了阶段性成果。金刚甲烷、金刚乙胺和达菲已经被批准用于预防人类禽流感。
击战取得了阶段性成果。金刚甲烷、金刚乙胺和达菲已经被批准用于预防人类禽流感。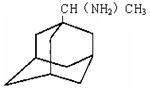
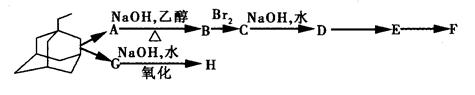
 ):
): 粤公网安备 44130202000953号
粤公网安备 44130202000953号