Ba(OH)2是重要的化工原料,工业上采用重晶石(主要成分为硫酸钡)和软锰矿(主要成分为二氧化锰,含有二氧化硅杂质)制备,同时得到碳酸锰等副产品。其工业流程如下:

已知:MnO2为两性氧化物,MnO为碱性氧化物。
(1)高温还原过程中,硫酸钡被碳还原为BaS,然后水浸得到。投料时煤炭的量相对要多其作用除了使硫酸钡充分反应外,还有 。
(2)氧化时反应还生成MnO和一种固体产物,则该反应的化学方程式为 ,氧化时控制MnO2与BaS的投料比在2~3之间,若投料比大于4,则Ba(OH)2的转化率明显降低,原因可能是
(3)酸化的离子反应方程式为 ,滤渣的主要成分为 。
(4)中和时通入氨气调节溶液的pH值,若pH值偏高,会造成碳酸锰不纯,原因是 。
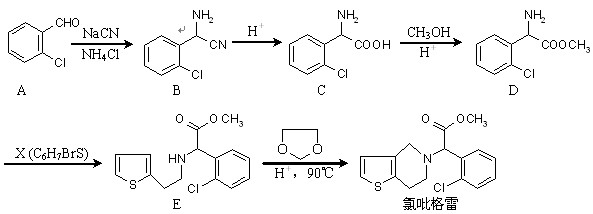
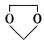 在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。
在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号