(14分)高铁酸盐在能源、环保等方面有着广泛的用途。高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。替代传统的净水剂及Cl2对淡水进行净化消毒是城市饮用水处理新技术。
工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解NaOH溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
(1)高铁酸钾具有强氧化性的原因是 。
(2)用异丙醇代替水洗涤产品的好处是 。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 , 。
(4)高铁电池是正在研制中的可充电干电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 、 。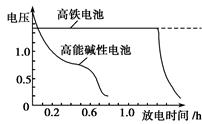
(5)探究高铁酸钾的某种性质。
[实验1]将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0 mmol·L-1(1 mmol·L-1=10-3 mol·L-1)的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。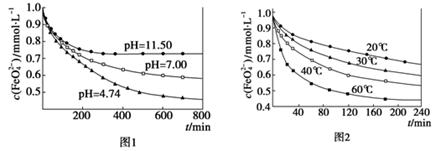
[实验2]将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1的试样,将试样分别置于20 ℃、30 ℃、40 ℃和60 ℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。

 HCl+HClO K=4.5×10-4
HCl+HClO K=4.5×10-4 CH3OH(g) ΔH
CH3OH(g) ΔH


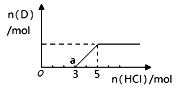
 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号