已知在25 ℃时,醋酸、碳酸、次氯酸、氢硫酸和亚硫酸的电离平衡常数分别为
CH3COOH:Ka=1.8×10-5
H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
HClO:Ka=3.0×10-8
H2S:Ka1=9.1×10-8 Ka2=1.1×10-12
H2SO3:Ka1=1.5×10-2 Ka2=1.0×10-7
(1)写出碳酸的第二级电离平衡常数表达式Ka2=__________。
(2)在25 ℃时,相同物质量浓度的上述四种酸溶液中,氢离子浓度最大的是 (填“醋酸”、“碳酸”、“次氯酸”、“氢硫酸”或“亚硫酸”,下同);水电离的氢离子浓度最大的是 。
(3)在25 ℃时,饱和氢硫酸溶液的物质的量浓度约为0.1mol·L-1,用广泛pH试纸测定其pH值的操作方法是: ;若此时测得溶液的pH=4,则此时氢硫酸的电离度= ;加水稀释饱和氢硫酸溶液,下列数值增大的是 。
A.c(HS-)
B.c(OH-)
C.c(H+)·c(OH-)
D.n(H+)·n(OH-)
E.c(HS-)/c(H2S)
(4)下列离子方程式中正确的是________。
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO+HClO
B.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
C.过量SO2通入碳酸钠溶液中:2SO2+H2O+CO32-===2HSO3-+CO2
D.过量CH3COOH加入碳酸钠溶液中:CH3COOH+CO32-===CH3COO-+HCO3-
 。
。 表示阿氏常数)
表示阿氏常数) ____;
____; 。
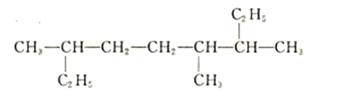
。
 ,属于反应;
,属于反应; ,另一产物是盐酸盐。
,另一产物是盐酸盐。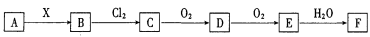
 粤公网安备 44130202000953号
粤公网安备 44130202000953号