有下列各组物质: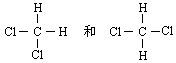
①石墨和碳纳米管 ②甲烷和十八烷 ③
④乙酸和甲酸甲酯 ⑤ 12CO2和14CO2 ⑥H、D、T
⑦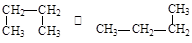 ⑧
⑧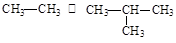
其中属于同分异构体的为 (填序号,下同);
属于同素异形体的为 ;
属于同位素的为 ;
属于同系物的为 ;
属于同一物质的为 ;
有下列各组物质: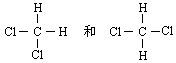
①石墨和碳纳米管 ②甲烷和十八烷 ③
④乙酸和甲酸甲酯 ⑤ 12CO2和14CO2 ⑥H、D、T
⑦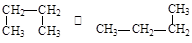 ⑧
⑧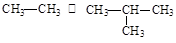
其中属于同分异构体的为 (填序号,下同);
属于同素异形体的为 ;
属于同位素的为 ;
属于同系物的为 ;
属于同一物质的为 ;