已知A、J为常见金属单质,常温下B为液体化合物,E是空气的主要成分之一,L是蓝色沉淀,H为红棕色气体;它们之间的转换关系如下图所示: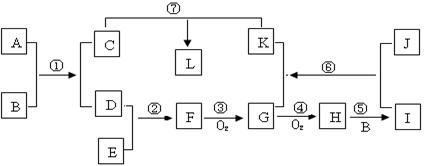
(1)H的化学式是________。
(2)③的化学方程式是__________________________________。
(3)⑥的离子方程式是_______________________________。
(4)F名称是________,检验此气体的方法是___________________________________。
已知A、J为常见金属单质,常温下B为液体化合物,E是空气的主要成分之一,L是蓝色沉淀,H为红棕色气体;它们之间的转换关系如下图所示:
(1)H的化学式是________。
(2)③的化学方程式是__________________________________。
(3)⑥的离子方程式是_______________________________。
(4)F名称是________,检验此气体的方法是___________________________________。