环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体。实验室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境。某化学兴趣尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮。有关物质信息、实验流程及实验装置如下:
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃)。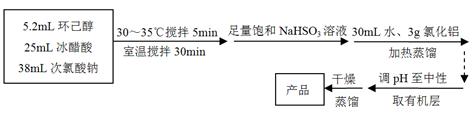

主反应:
回答下列问题:
(1)仪器A的名称是 。
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 、 。
(3)加入饱和NaHSO3溶液时发生的主要反应是 (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是 。
(4)为将馏出液的pH调至中性,可以加入的试剂是 。
| A.稀盐酸 | B.无水碳酸钠 | C.浓硫酸 | D.氢氧化钠固体 |
(5)调节pH后还需加入精制食盐,其目的是 ,“取有机层”时使用的主要仪器是 。(填下图对应的字母)。
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是 。
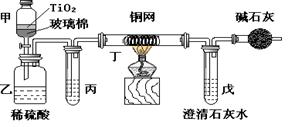
 KMnO4 + H2C2O4+ ()---K2SO4 + CO2↑+ MnSO4 + ()
KMnO4 + H2C2O4+ ()---K2SO4 + CO2↑+ MnSO4 + ()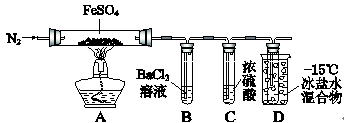

 )__________________________________________________________。
)__________________________________________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号