为探究铁质材料与热浓硝酸的反应,某学习小组进行了以下实验:
[探究一]
(1)铁钉放在浓硫酸中浸泡后,再用蒸馏水冲洗,然后放入硫酸铜溶液中,铁钉表面无明显变化,其原因是_____________________。
(2)另称取铁钉6.0g放入15.0ml浓硝酸中,加热,充分应后得到溶液M并收集到气体N。为了探究溶液M中铁元素的价态,甲同学设计了如下实验:
有药品:
| A.稀盐酸溶液 |
| B.稀硫酸溶液 |
| C.淀粉KI溶液 |
| D.KMnO4溶液 |
E.NaOH溶液
F.H2O2溶液
G.KSCN溶液
仪器:试管和滴管
步骤1.取试样,滴加少量的______(填试剂字母),溶液的颜色变____色,则试样中含有Fe3+,发生反应的离子方程式为________________。
步骤2.再去适量的试样滴加少量的______(填试剂字母),若溶液_______,则试样中含有Fe2+。
[探究二]
乙同学设计以下装置探究气体N的成分。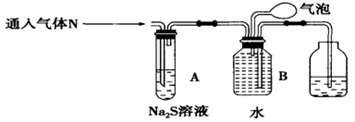
(3)A装置的作用:______________________。
(4)B装置收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体N中含NO____(填“能”或“不能”)?理由是________________。


 ,写出反应②的反应方程式(标明反应条件):_____________。
,写出反应②的反应方程式(标明反应条件):_____________。 2NO2(g)△H,随温度升高,混合气体的颜色变深。
2NO2(g)△H,随温度升高,混合气体的颜色变深。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号