某同学从资料上查到以下反应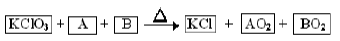
A、B为中学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体。回答下列问题:
(1)元素A、B可形成化合物AB2,则A元素的原子结构示意图为 ,AB2中的化学键是
(2)若反应中A和B的质量比为3:4,则n(KClO3):n(AO2)=
(3)已知:

写出AB2(l)在O2中完全燃烧的热化学方程式为
某同学从资料上查到以下反应
A、B为中学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体。回答下列问题:
(1)元素A、B可形成化合物AB2,则A元素的原子结构示意图为 ,AB2中的化学键是
(2)若反应中A和B的质量比为3:4,则n(KClO3):n(AO2)=
(3)已知:

写出AB2(l)在O2中完全燃烧的热化学方程式为