可逆反应:2NO2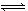 2NO+O2在恒温恒容密闭容器中反应,达到平衡状态的标志是
2NO+O2在恒温恒容密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤⑥ |
可逆反应:2NO2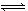 2NO+O2在恒温恒容密闭容器中反应,达到平衡状态的标志是
2NO+O2在恒温恒容密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤⑥ |