化学兴趣小组为探究某铁矿石(主要成分为Fe2O3和SiO2)的性质,进行如下实验: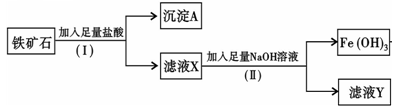
(1)步骤(I)中分离溶液和沉淀的操作名称是 ;
(2)沉淀A中一定含有 ,该物质属于 (填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈 (填“黄色”或“红色”)
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式 。
化学兴趣小组为探究某铁矿石(主要成分为Fe2O3和SiO2)的性质,进行如下实验:
(1)步骤(I)中分离溶液和沉淀的操作名称是 ;
(2)沉淀A中一定含有 ,该物质属于 (填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈 (填“黄色”或“红色”)
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式 。