掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。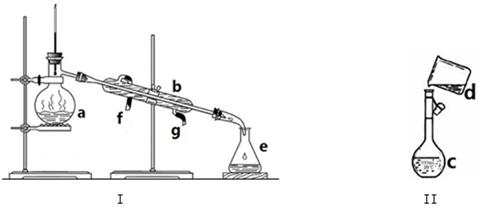
(1)写出下列仪器的名称:
a. b. c.
(2)仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行的实验操作的名称为: 。
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
(1)写出下列仪器的名称:
a. b. c.
(2)仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行的实验操作的名称为: 。