(10分)某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
| 实验编号 |
0.01mol·L-1 酸性KMnO4溶液 |
0.1mol·L-1 H2C2O4溶液 |
水 |
1mol·L-1 MnSO4溶液 |
反应温度 /℃ |
反应时间 |
| I |
2mL |
2mL |
0 |
0 |
20 |
125 |
| II |
____mL |
____mL |
1mL |
0 |
20 |
320 |
| III |
____mL |
___mL |
___mL |
0 |
50 |
30 |
| IV |
2mL |
2mL |
0 |
2滴 |
20 |
10 |
已知:反应的方程式(未配平):KMnO4 + H2C2O4 + H2SO4 —— K2SO4 + MnSO4 + CO2↑+ H2O
(1)实验记时方法是从溶液混合开始记时,至___ ___ __时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响。请在上表空格中填入合理的实验数据。
(3)从实验数据分析,实验I和IV研究________对反应的影响。
(4)请配平上面的化学方程式:
KMnO4 + H2C2O4 + H2SO4= K2SO4 + MnSO4 + CO2↑+ H2O

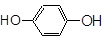 ;
; ;
; ;
;

 粤公网安备 44130202000953号
粤公网安备 44130202000953号