(每空2分,共12分)实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案: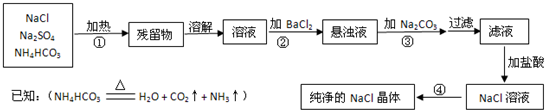
请回答下列问题:
(1)操作①加热的目的是______,发生的反应______(填“是”或“不是”)氧化还原反应.
(2)操作②除用BaCl2溶液外,还可以用______ .
(3)操作③的目的是_____ ,发生反应的方程式为: .
(4)操作④应在 (填仪器名称)中进行.
(每空2分,共12分)实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案:
请回答下列问题:
(1)操作①加热的目的是______,发生的反应______(填“是”或“不是”)氧化还原反应.
(2)操作②除用BaCl2溶液外,还可以用______ .
(3)操作③的目的是_____ ,发生反应的方程式为: .
(4)操作④应在 (填仪器名称)中进行.