[化学选修——2:化学与技术](15分)
海水是巨大的资源宝库,利用海水提取食盐的过程如图所示。回答下列问题: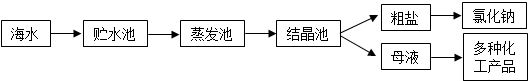
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液。加入试剂的顺序是 。
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为 ,与电源负极相连的电极附近溶液pH的变化是 。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,①则气体B是 (填化学式),由NaCl制取纯碱反应的化学方程为 、 。
(3)采用空气吹出法从浓海水吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收3mol Br2时,转移的电子数为 个。
(4)海水提镁的一段工艺流程如图: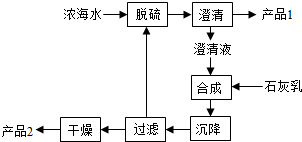
浓海水的主要成分如下:
| 离子 |
Na+ |
Mg2+ |
Cl- |
SO42- |
| 浓度/(g•L-1) |
63.7 |
28.8 |
144.6 |
46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,1L浓海水最多可得到产品2的物质的量为 mol。

 Si(s)+2CO(g)
Si(s)+2CO(g)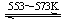 SiHCl3(l)+H2(g) + Q(Q>0)
SiHCl3(l)+H2(g) + Q(Q>0)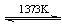 Si(纯)+3HCl(g)
Si(纯)+3HCl(g)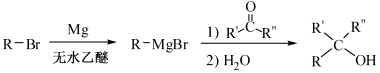

 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: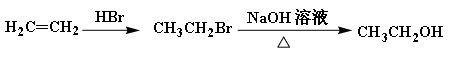


 粤公网安备 44130202000953号
粤公网安备 44130202000953号