工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下: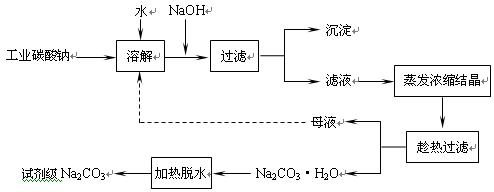
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: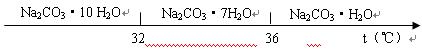
 (1)加入NaOH溶液时发生的离子反应方程式为 ▲ 、 ▲ 。
(1)加入NaOH溶液时发生的离子反应方程式为 ▲ 、 ▲ 。
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释) ▲ 。
(3)“趁热过滤”时的温度应控制在 ▲ 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式 ▲ 。
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行 ▲ ,其理由是 ▲ 。
 H++In—。则酸根离子In—的颜色是。甲基橙的酸性与草酸相比,(填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是。甲基橙的酸性与草酸相比,(填前者强、前者弱、十分接近、无法判断)。

 ,F能使溴的CCl4溶液褪色。请回答下列问题:
,F能使溴的CCl4溶液褪色。请回答下列问题:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号