(16分)(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L 酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
| 物理量 |
|
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| |
浓度/mol·L-1 |
体积/mL |
浓度/mol·L-1 |
体积/mL |
||
| ① |
0 |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
| ② |
0 |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
|
|
|
0.010 |
4.0 |
25 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n (KMnO4) ≥_______。
(2)请完成表格内五处空白。
(3)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=______________mol·L-1·min-1。
(4)已知50℃时c(MnO4—)~反应时间t的变化曲线如下图。其中反应速率最快的阶段是_____,原因是 。 
(二)利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________。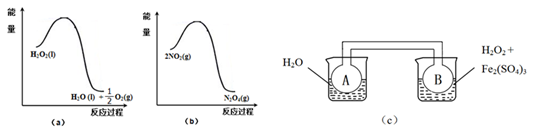
相关知识点
 粤公网安备 44130202000953号
粤公网安备 44130202000953号