已知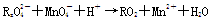 变化过程中,0.2 mol
变化过程中,0.2 mol 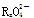 参加反应,共转移0.4 mol 电子。
参加反应,共转移0.4 mol 电子。
(1)反应的氧化产物为 。
(2)x=________。
(3)参加反应的氢离子的物质的量为________。
(4)配平题中的离子方程式并将配平后的式子写在下面横线上
已知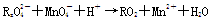 变化过程中,0.2 mol
变化过程中,0.2 mol 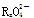 参加反应,共转移0.4 mol 电子。
参加反应,共转移0.4 mol 电子。
(1)反应的氧化产物为 。
(2)x=________。
(3)参加反应的氢离子的物质的量为________。
(4)配平题中的离子方程式并将配平后的式子写在下面横线上