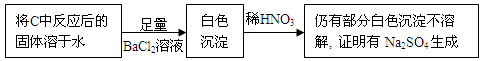
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
试回答:
(1)操作I为 (填写操作名称)。
(2)操作III的顺序依次为: 、冷却结晶、过滤 、 、干燥。
(3)试剂Y(一种单质)与溶液X反应的离子方程式为 。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)
③滴定时发生反应的离子方程为:
④若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为




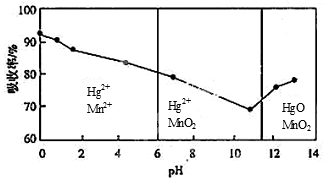
 SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: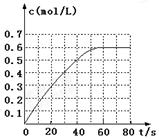
 粤公网安备 44130202000953号
粤公网安备 44130202000953号