按以下装置图进行实验,填写有关现象及化学方程式。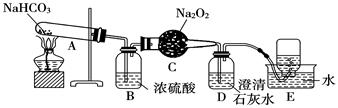
(1)A中现象是____________________,
(2)B中浓硫酸的作用是_______________,
(3)C中发生反应的化学方程式为______________,
(4)D中现象是_______________;反应的离子方程式是_______________________,
(5)E中收集的气体是____________。
按以下装置图进行实验,填写有关现象及化学方程式。
(1)A中现象是____________________,
(2)B中浓硫酸的作用是_______________,
(3)C中发生反应的化学方程式为______________,
(4)D中现象是_______________;反应的离子方程式是_______________________,
(5)E中收集的气体是____________。