2011年3月,日本发生9级地震,地震引发海啸及伤亡。灾区重建面临多种困难,其中饮水安全是重要问题之一。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
(1)高铁酸钾中铁元素的化合价为_______价,推测它具有的化学性质是____ __。
(2)在次氯酸钠(NaClO,84消毒液的主要成分)溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。发生的离子反应为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,氧化剂是________。将KOH加入到反应后的溶液搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为2KOH+Na2FeO4====K2FeO4+2NaOH。根据复分解反应原理,高铁酸钠的溶解度________高铁酸钾的溶解度(填“大于”、“小于”或“等于”)。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬)。有关离子方程式为FeO42-+CrO2-+2H2O====CrO42-+Fe(OH)3↓+OH-,2CrO42-+2H+====Cr2O72-+H2O,Cr2O72-+6Fe2++14H+====2Cr3++6Fe3++7H2O
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液30.00 mL。计算上述实验制得的样品中,高铁酸钾的质量分数为__________;
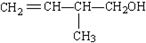
 的结构简式_________;
的结构简式_________;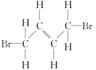 的键线式______;
的键线式______;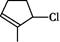 的分子式___________。
的分子式___________。 __________________________________
__________________________________
 粤公网安备 44130202000953号
粤公网安备 44130202000953号