(18分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程: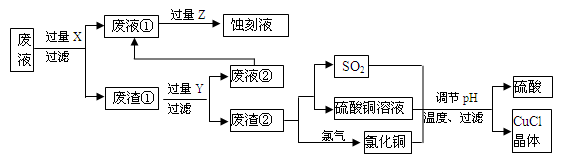
按要求回答下列问题:
(1)废液①的主要含有的金属阳离子是_____(填化学符号,下同);废渣①的主要含有的物质是________;Y为_______。
(2)检验Z过量的方法是______________________________。
(3)写出废渣②生成二氧化硫的化学方程式___________________________。
(4)为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
(5)生产过程中调节溶液的pH不能过大的原因是____________________________。
(6)写出产生CuCl的离子方程式___________________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g加入10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;
②待样品溶解后,加水50ml和2滴指示剂;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 =CuCl2 + FeCl2;Fe2+ + Ce4+= Fe3+ + Ce3+。则CuCl的纯度为____________。


 。
。 实现的是(填气体
实现的是(填气体
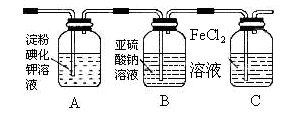
 式为:
式为:
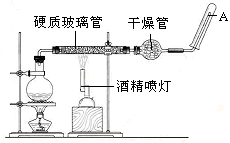
 。
。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号