(17分)按要求回答下列问题:
(1)实验室铝粉和Fe2O3作铝热反应实验,铝热反应的方程式为_________,该实验中除用到铝粉和Fe2O3外,需要的试剂还有 (填编号)。
a.KClO3 b.Mg c.MnO2 d.KCl
(2)据文献报道,在实际反应中铝热反应的产物成分较为复杂。某课题组对铝热反应产物的成分进行探究,经成分分析,发现主要得到甲和乙两种产物。甲由具有相同电子层结构的阴、阳离子构成;乙是一种铁铝的金属互化物(可用FexAly表示),取该合金粉末2.47g,滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体在空气中充分加热、灼烧得红棕色粉末1.60g。
①甲的化学式为______,乙中x=_____,y=_______。
②甲的晶体是耐高温材料,用此材料做成的坩埚,不能用来熔融NaOH,用化学方程式解释其原因______;含二氧化硅材料做成的坩埚_____(填“能”或“不能”)用来熔融NaOH。
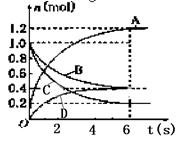
③下图表示室温下相同组分的乙分别在两种不同的酸中的腐蚀情况,
由图可知,乙在______中具有比较强的抗腐蚀性,原因可能是______。
④研究发现铝热反应后期温度高达2000℃以上时会有极微量的Al4C3生成,Al4C3遇水会产生一种气体,该气体的分子式为________。[已知CaC2+2H2O=Ca(OH)2+C2H2↑]
(3)镁铝互化物(Mg17Al12)是一种潜在的贮氢材料,该金属互化物在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al。得到的混合物在6.0 mol·L-1 HCl中,能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号