甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般可采用下列反应合成甲醇:
CO(g) + 2H2(g) 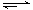 CH3OH(g) ΔH
CH3OH(g) ΔH
①下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.04 |
0.25 |
0.012 |
由表中数据判断ΔH 0 (填“>”、“=”或“<”)。
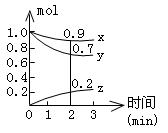
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,5min该反应达到平衡,测得c(CO)= 0.2 mol/L,则用H2表示的5min内该反应的反应速率为 ,此时的温度为 (从上表中选择)。
③300℃时,向2L的密闭容器中投入CH3OH(g)发生反应I,达平衡时CH3OH(g)的分解率是50%,求起始投入CH3OH(g)的物质的量 mol。
(2)在压强为0.1 MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
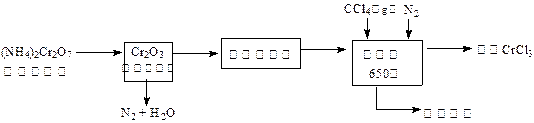
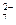 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。 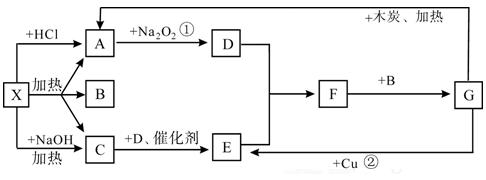
 写出反应×→C的
写出反应×→C的 式:
式:
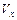 =,
=,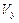 =,
=,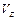 =,
=,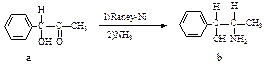
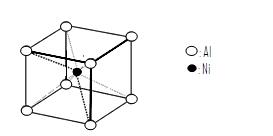
 物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。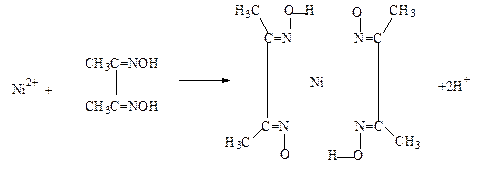
 粤公网安备 44130202000953号
粤公网安备 44130202000953号