研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质,目前人们已研发多种饮用水的新型消毒剂。亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(1)在发生器中鼓入空气的作用可能是_________________________________。吸收塔内发生反应的化学方程式为_____________________。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成0.5 mol Cl2时,反应中转移电子的个数是________。
(2)吸收塔的温度不能超过20℃,其目的是_____________。吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性物质中除H2O2外,还可以选择的还原剂是_____(选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(3)从滤液中得到的NaClO2·3H2O晶体的操作依次是__________(填写序号)。
a.蒸发 b.灼烧 c.过滤 d.冷却结晶
(4)印染工业常用亚氯酸钠(NaClO2)漂白织物。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体,25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。
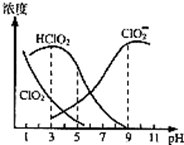
回答下列问题:
①该温度下NaClO2溶液中c(Na+)__________c(ClO2-)(填“>”“=”或“<”),原因是________________________________(用一个离子方程式表示);
②使用该漂白剂的最佳pH为_____;
| A.3.0 | B.4.0-4.5 | C.6.5-7.0 | D.9.0 |
③根据图中数据,当pH=8时,往NaClO2溶液中滴入稀盐酸,溶液中主要反应的离子方程式为_______。
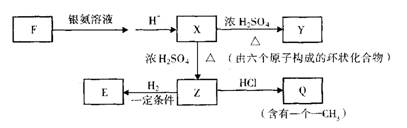
 ④CH3COONH4
④CH3COONH4 。常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号)>>
。常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号)>> 2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题: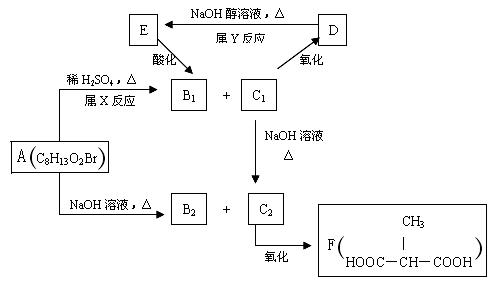
 C2的化学方程式。
C2的化学方程式。 粤公网安备 44130202000953号
粤公网安备 44130202000953号