在2L密闭容器中,充入a molN2和b molH2,在一定温度下N2+3H2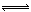 2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是 ,H2的转化率是 ,容器中H2的平衡浓度是 mol/L,该温度下平衡常数的数值为 。(用a、b、c表示出计算式即可)
2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是 ,H2的转化率是 ,容器中H2的平衡浓度是 mol/L,该温度下平衡常数的数值为 。(用a、b、c表示出计算式即可)
在2L密闭容器中,充入a molN2和b molH2,在一定温度下N2+3H2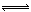 2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是 ,H2的转化率是 ,容器中H2的平衡浓度是 mol/L,该温度下平衡常数的数值为 。(用a、b、c表示出计算式即可)
2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是 ,H2的转化率是 ,容器中H2的平衡浓度是 mol/L,该温度下平衡常数的数值为 。(用a、b、c表示出计算式即可)