根据官能团的不同对下列有机物进行分类。把正确答案的序号填写在题中的横线上。
①CH3CH2OH 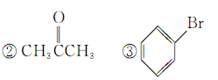
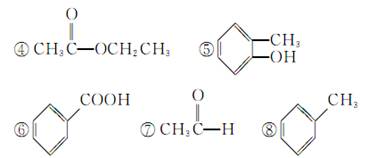
(1)芳香烃:________;(2)卤代烃:____________;
(3)醇:____________;(4)酚:________________;
(5)醛:____________;(6)酮:________________;
(7)羧酸:__________;(8)酯:________________。
根据官能团的不同对下列有机物进行分类。把正确答案的序号填写在题中的横线上。
①CH3CH2OH 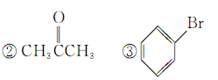

(1)芳香烃:________;(2)卤代烃:____________;
(3)醇:____________;(4)酚:________________;
(5)醛:____________;(6)酮:________________;
(7)羧酸:__________;(8)酯:________________。