某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1 。 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)写出元素D在周期表中的位置是 ,B原子的外围电子排布图 。填出:E原子的核外有 种不同运动状态的电子,
B和C的第一电离能大小关系 (用元素符号表示)。
(2)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,画出原子个数比为1:1的化合物的电子式 ,两种化合物可任意比互溶,解释其主要原因为 。
(3)该配位化合物的化学式为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。用电子式表示化合物Na2D2的形成过程 。
(5)已知E的晶胞结构如下图所示,此晶胞立方体的边长为a cm,E单质的密度 为ρg·cm-3,则阿伏加德罗常数为 (用a、ρ表示)。该晶胞配位数为 ,EDC4常作电镀液,其中DC 的空间构型是 ,其中D原子的杂化轨道类型是 ,若电解EDC4的水溶液,则电解总反应的化学方程式为 。
的空间构型是 ,其中D原子的杂化轨道类型是 ,若电解EDC4的水溶液,则电解总反应的化学方程式为 。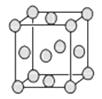
 KI3
KI3 粤公网安备 44130202000953号
粤公网安备 44130202000953号