已知:
| 酸 |
电离常数(Ka) |
酸 |
电离常数(Ka) |
| CH3COOH |
1.8×10-5 |
HCN |
5×10-10 |
| H2CO3 |
Ka1 =" " 4.2×10-7 |
HClO |
3×10-8 |
| Ka2 =" " 5.6×10-11 |
(1)用方程式表示HCN溶液显酸性的原因:______________________________。
(2)上述四种酸中,酸性最强的是 ;
(3)25℃时,0.01 mol/L NaCN溶液的pH________7;
(4)在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为 ;
(5)向pH=4的CH3COOH溶液中,加入下列物质,能使CH3COOH电离平衡向逆向移动的是:_________________。
①加入少量NH4Cl固体 ②加入等体积pH=5的盐酸
③加入少量Na2CO3固体 ④加入等体积0.01 mol/L的CH3COONa 溶液

 O(g)+O2(g)
O(g)+O2(g) 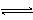 2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表: 该反应的平均速率v= . mol/(L·s)
该反应的平均速率v= . mol/(L·s)
 应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________,实验现象为______________________________________。
应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________,实验现象为______________________________________。 O
O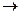 Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2 mol e-,生成标准状况下N2的体积__________ L。
mol e-,生成标准状况下N2的体积__________ L。 _
_ _______________;B _
_______________;B _ 粤公网安备 44130202000953号
粤公网安备 44130202000953号