(10分,每小题2分)为除去粗盐中的Ca2+,Mg2+,Fe3+,SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐
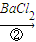
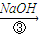
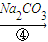
 滤液
滤液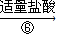
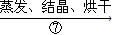 精盐.
精盐.
(1)判断BaCl2已过量的方法是______.
(2)第④步中,相关的离子方程式是______.
(3)除杂试剂加入顺序必须满足 。若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因 。
(10分,每小题2分)为除去粗盐中的Ca2+,Mg2+,Fe3+,SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐
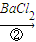
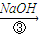
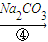
 滤液
滤液
 精盐.
精盐.
(1)判断BaCl2已过量的方法是______.
(2)第④步中,相关的离子方程式是______.
(3)除杂试剂加入顺序必须满足 。若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因 。