海水中不仅含有丰富的非金属元素资源,(如Cl,Br,I等),还含有丰富的金属元素资源(如Na,Mg,Fe,Cr等),
(1)海水晒盐的原理是: ;与Na,Cl同周期,且简单离子半径最小的离子结构示意图: (2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是: ;(填序号)
①加稀HCl滤液至酸性,②过滤除去杂质,③加过量NaOH溶液,④加过量Na2CO3溶液⑤加过量BaCl2溶液⑥溶解,⑦蒸发结晶;
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体。
有关资料:
| M(OH)n |
pH |
|
| 开始沉淀 |
沉淀完全 |
|
| Fe(OH)2 |
7.6 |
9.6 |
| Fe(OH)3 |
2.7 |
3.7 |
| Mg(OH)2 |
9.5 |
11.0 |
| Cr(OH)3 |
4.3 |
5.0 |
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,
则最佳试剂选择和操作是:
①先加 ;目的是 ;
②再加 ;目的是 ;
③过滤后,为能得到纯净Mg Cl2晶体,采用的操作方法是: ;
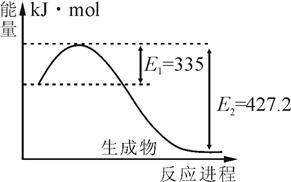
 2NH3(g)△H<0,得到如下数据:
2NH3(g)△H<0,得到如下数据:

 实验操作
实验操作 步骤3:取1mL0.1mol/L KI和1mL0.1mol/LFeCl2溶液于试管中,混合后滴入2~3滴新制氯水,振荡。
步骤3:取1mL0.1mol/L KI和1mL0.1mol/LFeCl2溶液于试管中,混合后滴入2~3滴新制氯水,振荡。
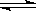 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________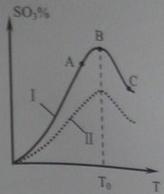
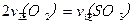
 粤公网安备 44130202000953号
粤公网安备 44130202000953号