A、B、C、D、E均为中学化学常见物质,A是短周期原子半径最大的元素(稀有气体除外)构成的单质,E既可溶于盐酸又可溶于NaOH溶液,它们之间的反应关系如图所示: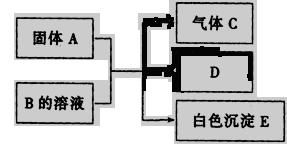
(1)E溶于NaOH溶液的离子方程式为 ;
(2)工业上冶炼A的化学反应方程式为 ;
(3)气体C在使用前需要检验纯度,操作方法是 。
A、B、C、D、E均为中学化学常见物质,A是短周期原子半径最大的元素(稀有气体除外)构成的单质,E既可溶于盐酸又可溶于NaOH溶液,它们之间的反应关系如图所示:
(1)E溶于NaOH溶液的离子方程式为 ;
(2)工业上冶炼A的化学反应方程式为 ;
(3)气体C在使用前需要检验纯度,操作方法是 。