某反应中反应物与生成物有: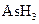 、
、 、
、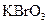 、
、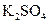 、
、 、
、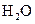 和一种未知物质X。
和一种未知物质X。
 (1)已知
(1)已知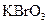 在反应中得到电子,则该反应的还原剂是 。
在反应中得到电子,则该反应的还原剂是 。 (2)已知0.2mol
(2)已知0.2mol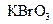 在反应中得到1mol电子生成X,则X的化学式为 。
在反应中得到1mol电子生成X,则X的化学式为 。 (3)根据上述反应可推知 。
(3)根据上述反应可推知 。 a.氧化性:
a.氧化性: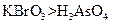 b.氧化性:
b.氧化性: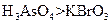
 c.还原性:
c.还原性: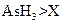 d.还原性:
d.还原性:
 (4写出该反应的化学方程
(4写出该反应的化学方程 式,并标出电子转移的方向
式,并标出电子转移的方向 和数目:
和数目:
某反应中反应物与生成物有: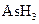 、
、 、
、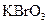 、
、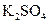 、
、 、
、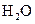 和一种未知物质X。
和一种未知物质X。
 (1)已知
(1)已知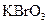 在反应中得到电子,则该反应的还原剂是 。
在反应中得到电子,则该反应的还原剂是 。 (2)已知0.2mol
(2)已知0.2mol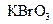 在反应中得到1mol电子生成X,则X的化学式为 。
在反应中得到1mol电子生成X,则X的化学式为 。 (3)根据上述反应可推知 。
(3)根据上述反应可推知 。 a.氧化性:
a.氧化性: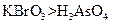 b.氧化性:
b.氧化性: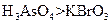
 c.还原性:
c.还原性: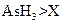 d.还原性:
d.还原性:
 (4写出该反应的化学方程
(4写出该反应的化学方程 式,并标出电子转移的方向
式,并标出电子转移的方向 和数目:
和数目: