下列共有十二种化学符号:
①O2 ②614C ③238U ④1123Na ⑤O3 ⑥714N ⑦1224Mg ⑧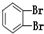
⑨235U ⑩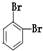 (11)
(11)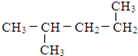 (12)
(12)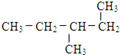
其中:
(1)表示核素的符号共有___种.
(2)互为同位素的是___(填序号,以下相同)
(3)质量数相等,但不能互称同位素的是__
(4)中子数相等,但质子数不相等的是___.
(5)互为同素异形体的是___.
(6)互为同分异构体的是___.
下列共有十二种化学符号:
①O2 ②614C ③238U ④1123Na ⑤O3 ⑥714N ⑦1224Mg ⑧
⑨235U ⑩ (11)
(11)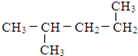 (12)
(12)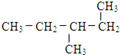
其中:
(1)表示核素的符号共有___种.
(2)互为同位素的是___(填序号,以下相同)
(3)质量数相等,但不能互称同位素的是__
(4)中子数相等,但质子数不相等的是___.
(5)互为同素异形体的是___.
(6)互为同分异构体的是___.