某实验小组用0.55 mol/L NaOH溶液和0.50 mol/L盐酸反应来测定中和热,实验装置如下图所示。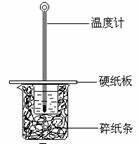
(1)图示实验装置中缺少的一种仪器是 ,大、小烧杯间填满碎纸条的作用是 。
(2)取50 mL NaOH溶液和50mL盐酸进行实验,实验数据如下表:
①请填写下表中的空白:
| 温度 次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值(t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.1 |
3.0 |
| 2 |
25.9 |
25.9 |
25.9 |
28.8 |
|
| 3 |
26.4 |
26.2 |
26.3 |
29.4 |
②近似认为0.55mol/L NaOH溶液和0.50 mol/L盐酸的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热△H= (结果保留小数点后一位)。
③氢氧化钠溶液稍过量的原因是 。
④上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是 (填字母)。
a. 实验装置保温、隔热效果差
b. 用量筒量取盐酸时俯视读数
c. 分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d. 用温度计测定NaOH溶液起始温度后直接测定盐酸的温度


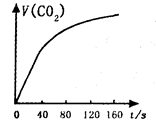
 的速率快慢进行了研究。他们实验时所用的试剂和使用的反应条件如下表所示:
的速率快慢进行了研究。他们实验时所用的试剂和使用的反应条件如下表所示: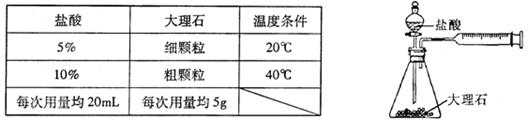





 粤公网安备 44130202000953号
粤公网安备 44130202000953号