(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有 和 。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min |
1 |
2 |
3 |
4 |
5 |
| 体积/mL |
50 |
120 |
232 |
290 |
310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为________。
③试分析1~3min时间段里,反应速率变大的主要原因 。
(3)对于容积固定的反应:N2(g)+3H2(g)  2NH3(g)(正反应放热),达到平衡的标志有___ 。
2NH3(g)(正反应放热),达到平衡的标志有___ 。
A N2、H2、NH3的百分含量不再变化 B 总压强不变
C N2、H2、NH3的分子数之比为1∶3∶2 D N2、H2、NH3的浓度相等
E.N2、H2不再起反应 F.v(N2)=v(H2)
G.混合气体的密度不变 H.混合气体的平均相对分子质量不变
I.正反应放出的热量等于逆反应吸收的热量
相关知识点

 _______。
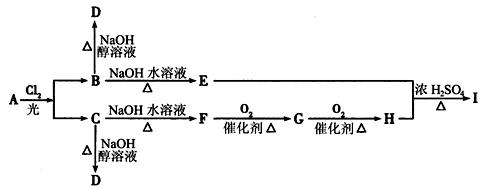
_______。
 完全反应,生成Ag的质量为____________g。
完全反应,生成Ag的质量为____________g。 ______。
______。 l 的有机物和0.2mol的O2在密闭容器中燃烧后的产物为CO2、CO和H2O(气),产物通过浓H2SO4后,质量增加5.4g,再通过灼热的Fe2O3,充分反应后,氧化铁质量减轻了1.6g
l 的有机物和0.2mol的O2在密闭容器中燃烧后的产物为CO2、CO和H2O(气),产物通过浓H2SO4后,质量增加5.4g,再通过灼热的Fe2O3,充分反应后,氧化铁质量减轻了1.6g ;最后气体再通过碱石灰完全吸收,质量增加8.8g。
;最后气体再通过碱石灰完全吸收,质量增加8.8g。 )=c(Cl-),则溶液中的pH值7,混和前c(NH3·H2O)c(HCl),氨水中c(OH-)盐酸中c(H+)。(填>、<或=,下同)
)=c(Cl-),则溶液中的pH值7,混和前c(NH3·H2O)c(HCl),氨水中c(OH-)盐酸中c(H+)。(填>、<或=,下同) 粤公网安备 44130202000953号
粤公网安备 44130202000953号